Введение
Микрофлора представляет собой совокупность сообществ микроорганизмов, живущих в определённой среде или на определённой поверхности организма. В последнее время кишечный микробиом всё чаще стали называть отдельным органом, играющим важное значение в жизнедеятельности всего организма. Эубиоз является начальным и базовым барьером организма при проникновении чужеродных агентов. Нормальная микрофлора кишечника способствует активизации активности иммунитета и подавлению развития вирулентных микроорганизмов путём выработки специфических и неспецифических веществ. Одним из главных условий эффективности работы системы колонизационной резистентности является количественный и качественный состав микробиома. К числу определяющих факторов данного явления относится агрегирующая способность микробов в биотопе за счёт возможности фиксации на строго специфическом рецепторе чувствительной клетки ткани макроорганизма. Этот процесс осуществляется при специфическом лиганд-рецепторном взаимодействии адгезинов микроорганизмов с определённым рецептором клетки ткани. Функцию адгезинов могут выполнять лектины, обладающие видовой специфичностью и отличающиеся вариабельностью химического строения, а также пили общего типа у грамотрицательных бактерий и компоненты пептидогликана у грамположительных [Симонова : 22]. Эти особенности способствуют образованию нормальной микрофлоры определённого биоценоза.
При изменении качественного и количественного состава нормальной микрофлоры возникает дисбактериоз (дисбиоз), при этом происходит развитие патогенной микрофлоры, включающей в себя преобладание колоний вирулентных микроорганизмов. Это состояние характеризуется угнетением барьерной функции микробиома, что способствует уменьшению устойчивости организма к стрессогенным факторам среды.
Основная часть микроорганизмов поступает в организм рыбы с водой и пищей в начальный период экзогенного питания [Кузьмина : 25]. Впоследствии, первичная проходящая микрофлора становится многочисленней, разнообразнее и приобретает специфичность. Становление устойчивой системы «макроорганизм – микроорганизм» происходит посредством сукцессий [Симонова : 20].
Известные данные о доминирующих видах кишечной микрофлоры рыб немногочисленны и относятся в основном к прошлому столетию. Видовой состав индигенной микрофлоры малочисленный, но количество видов в нём является преобладающим. Среди представителей микрофлоры кишечника рыб идентифицированы виды родов Acinetobacter spp., Aeromonas spp., Bacterium spp., Clostridium spp., Enterobacter spp., Flavobacterium spp.,, Micrococcus spp., Lactobacillus spp., Pseudomonas spp., Proteus spp. [Зайцева : 47]; [Германова : 67]. Присутствие небольшого количества таксонов микроорганизмов в кишечнике рыбы может не только отражать малое их разнообразие, но и говорить о недостаточной его изученности. Также изучение состава микробиоты затруднено его относительным непостоянством, вызванным главным образом высокой чувствительностью к микробиологическому составу окружающей среды. На состав аутофлоры влияют токсические вещества, вирусные и бактериальные агенты, паразитические организмы, многочисленные биотехнологические приёмы, связанные с интенсификацией рыборазведения [Сидорова : 25].
С 1968 г. и по настоящее время в Карелии проводятся работы по садковому выращиванию форели. Спустя 40 лет объёмы её производства на 47 хозяйствах Карелии достигли 12000 т. [Ильмаст : 22]. Такой способ рыбоводства представляет собой одну из современных технологий увеличения эффективности рыбохозяйственного освоения водных ресурсов. В настоящее время Республика Карелия является лидером производства форели (70 %) в России.
В условиях искусственного выращивания радужная форель потребляет самые различные компоненты в составе кормосмесей [Мирошникова : 26]. При интенсивных технологиях выращивания рыб, где используются корма с высоким содержанием белков животного и микробиального синтеза, наиболее часто встречаются заболевания, вызванные заражёнными кормами. Наиболее опасными микроорганизмами в кормах являются: кишечная палочка, дрожжеподобные и плесневые грибы. [Бурлаченко : 7]; Они являются условно-патогенными организмами, могут принимать участие в процессах переваривания пищи в кишечнике, будучи симбионтами, но при ухудшении условий могут трансформироваться в возбудителей заболеваний [Абросимова : 29].
Общее количество бактерий в содержимом кишечника колеблется от 3×102 до 7×108 клеток/г. Характер их размещения отражают следующие данные: в слизистой кишечника бактерий на 2-3 log единицы меньше, чем в его содержимом [Spanggaard : 2].
Цель исследования: селекция метаболически активных бактериальных штаммов индигенной микрофлоры Parasalmo mykiss Walbaum для последующей разработки на их основе аутобиотических препаратов.
Материалы и методы исследования
Объектом исследования является микрофлора кишечника 20 особей радужной форели (Parasalmo mykiss Walbaum) возрастной группы 1+. Определение состава микробиоценоза происходило на экспериментальных группах рыбы. Для отбора видов-аутобиотиков использовали общепринятые подходы к исследованию качественного и количественного биоразнообразия микроорганизмов ЖКТ и «Правила отбора патологического материала, R крови, корма и пересылка их для лабораторных исследований», включённых в Сборник инструкций по борьбе с болезнями рыб1. Предварительно рыбу анестезировали гвоздичным маслом (Cariophyllia cetheroleum, Oleum Caryophylli) и измеряли пластические и меристические признаки, принятые в рыбоводстве.
Из ЖКТ рыбы изымалась часть средней кишки длиной 10 мм, затем данный материал помещался в среду для консервации органов. Хранение осуществлялось в холодильнике при температуре 2 °С в течение недели. Затем при помощи микробиологической петли было собрано по 1 г отложений осадка и поверхностной биоплёнки из каждой пробирки с собранным материалом. Методом штриха были сделаны посевы кишечной микрофлоры на агаризованную универсальную питательную среду: гидролизат рыбной муки (ГРМ). Культивирование осуществлялось в термостате при температуре 37 °С в течение 48 часов. Затем была произведена оценка параметров выросших колоний микроорганизмов, а также вычислена частота их встречаемости среди всех образцов. К фенотипическим признакам относили следующие: морфологические, тинкториальные, культуральные и биохимические. Из каждой колонии наиболее часто встречающихся микроорганизмов были выращены чистые культуры путём последовательного трёхкратного посева на ГРМ-агар. Выросшие колонии были генотипированы. Идентификацию бактерий до вида выполняли с использованием ПЦР-анализа, выполненного методом секвенирования ДНК по Сэнгеру. Определение наиболее близкородственных последовательностей генов 16S рРНК выполняли с помощью онлайн-сервиса BLAST2.
Оценку ферментативной активности бактерий в отношении каталазы выполняли с использованием биохимической тест-системы «Микро-КАТАЛАЗА-НИЦФ». В состав набора входит 10 %-ый раствор перекиси водорода. Метод определения основан на способности фермента (каталазы) расщеплять Н₂О₂ до кислорода. При определении активности фермента учитывали время реакции и интенсивность выделения газа.
Для выявления бактериальной цитохромоксидазы применяли тест-систему «Микро-ЦИТОХРОМОКСИДАЗА-НИЦФ». Состав набора: тетраметил-n-фенилендиаминдигидрохлорид и растворитель. Метод основан на способности фермента цитохромоксидазы окислять кислород, содержащийся в растворе, до высокоактивного аниона, который легко окисляет ароматические спирты и амины до полимерных продуктов, окрашенных в синий цвет. Положительной считалась реакция, при которой в течение 30-60 секунд появлялось синее окрашивание. При отсутствии данного признака в течение первых 60 секунд реакция считалась отрицательной.
Для выявления доминантных групп энтеробактерий использовали методику количественной оценки доминирования в экологических сообществах [Баканов : 37]. Для статистической обработки полученных данных использовали программу Excel 2003.
Результаты и обсуждение
В результате исследования 20 образцов ассоциативной микрофлоры кишечника радужной форели был изучен качественный и количественный составы микробиома. В исследуемых образцах идентифицированы представители типов Actinobacteria и Bacillota. В условиях развития общего адаптационного синдрома в составе микробиома желудочно-кишечного тракта форели исследуемой возрастной группы оставался стабильным филум Actinobacteria на уровне 11 % и Bacilota - на уровне 24 %. Среди Actinobacteria выделены константные доминанты рода Propionibacterium, а среди Bacillota - Bacillus, Lactobacillus и Staphylococcus. Доля Propionibacterium в сообществе достигала 5.2 %.
По признакам биологической активности было отобрано 14 доминантных поликультур, способных эффективно метаболизировать субстраты. В результате бактериоскопического анализа описано 16 морфотипов, по тинкториальным признакам они были отнесены к грамположительным (13 культур) и грамотрицательным (3 культуры) бактериям. В результате бактериологического анализа описаны культуры с разным спектром биохимической активности в отношении каталазы и цитохромоксидазы: каталазной активностью обладали 21 % изученных культур, наличие цитохромоксидазы было зафиксировано у 36 % культур. Впоследствии были получены чистые культуры и оценены их культуральные признаки. Полученные данные по фенотипическим признакам соотносятся с данными, полученными в результате генотипирования. Среди Actinobacteria выделены константные доминанты рода Propionibacterium spp., а среди Bacillota – Bacillus spp., Lactobacillus spp. и Staphylococcus spp. Доля Propionibacterium spp. в сообществе достигала 5.2 %., Bacillus spp. 6.4 %, Propionibacteriuni spp. 5.2 %, Lactobacillus spp. 3.9 %, Staphylococcus spp. 3.2 %. Доля встречаемости доминантных таксономических единиц Actinobacteria и Bacillota представлена на гистограммах с группировкой (рис. 1 и 2).
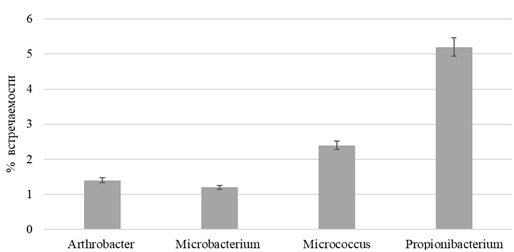
Рис. 1. Встречаемость кишечной бактериофлоры типа Actinobacteria
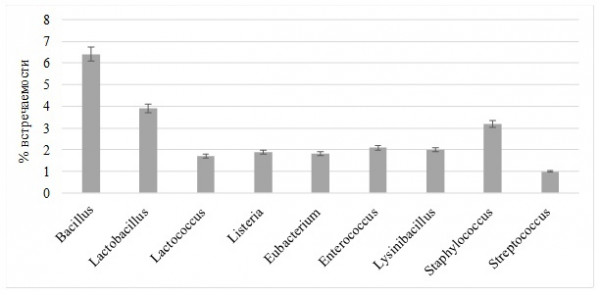
Рис. 2. Встречаемость кишечной бактериофлоры типа Bacillota
Эти представители эубиоза Parasalmo mykiss являются наиболее метаболически активными среди всех изученных микроорганизмов. Особое значение имеет выделение представителей рода Lactobacillus spp., которые являются важным компонентом интестинальной микрофлоры кишечника форели. Среди лактобактерий типированы 4 вида - L. brevis, L. hammesii, L. senmaizukei и L. parabrevis. Результаты BLAST-анализа последовательности ПЦР-продуктов на примере генотипирования представителей р. Lactobacillus представлены в типовом протоколе (табл. 1).
Таблица 1.
Результаты BLAST-анализа последовательности ПЦР-продуктов
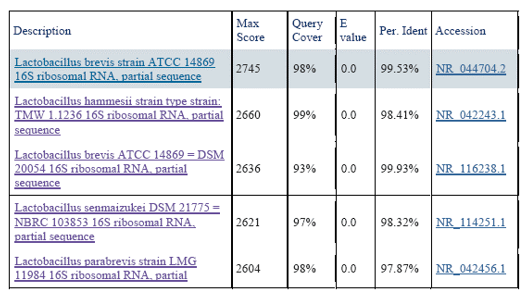
Необходимо отметить, что молочнокислые бактерии рода Lactobacillus spp. контролируют антагонизм в отношении условно-патогенных и патогенных бактерий, участвуют в обеспечении хозяина физиологически активными комплексами ферментов и могут считаться перспективными для разработки на их основе биопрепаратов-адаптогенов для радужной форели.
В результате выполненного исследования по оценке разнообразия микрофлоры кишечника радужной форели проанализированы первичные данные по таксономической структуре эубактерий 20 особей радужной форели в возрасте 1+. Несмотря на полученные с помощью методов высокопроизводительного секвенирования объективные данные по биоразнообразию микроорганизмов в составе микробиома кишечника P. mykiss, в обзоре научной литературы не обнаружено достаточного экспериментального материала о составе бактерий, способных колонизировать кишечник форели, включая виды, привнесенные с кормом и водой. В контексте задач исследования по поиску перспективных видов-аутобиотиков, недостаточно данных о видах микроорганизмов в составе ассоциативного симбиоза, включая большую группу потенциальных аутобиотиков, имеющих целый ряд преимуществ по сравнению с известными моно- и поликультурами пробиотических бактерий. Качественная и количественная изменчивость микробиома кишечника форели в зависимости от возраста, изменения обмена веществ, изменения иммунитета, действия стресс-факторов, развития общего адаптационного синдрома, изучена крайне слабо, хотя имеет большую ценность для определения физиологического статуса рыбы, поскольку кишечная бактериофлора очень быстро реагирует на изменение иммунного, возрастного, трофического или иного статуса хозяина и при этом выстраивает собственную экологическую стратегию.
Полученные данные необходимы как для обоснования и широкого применения микробиологических и молекулярных методов в практике пространственного и временного мониторинга за физиологическим состоянием форели, так и для создания фонда коллекции видов-аутобиотиков для объектов аквакультуры.
Примечания
1 Сборник инструкций по борьбе с болезнями рыб. Москва: Департамент ветеринарии, Межведомственная ихтиологическая комиссия Департамента рыболовства Минсельхозприрода России, 1998. С. 53-59.
2 BLAST: Basic Local Alignment Search Tool // National Center for Biotechnology Information [site]. URL: https://blast.ncbi.nlm.nih.gov/Blast.cgi (accessed: 25.10.2023).
Список литературы
Абросимова К.С. Оптимизация кормов и кормления молоди осетровых рыб для профилактики и лечения тимпании в интенсивной аквакультуре: дис. ... канд. биол. наук. Астрахань, 2015. 126 с.
Баканов А.И. Количественная оценка доминирования в экологических сообществах // Количественные методы экологии и гидробиологии. Тольятти: СамНЦ, 2005. С. 37-67.
Бурлаченко И.В. Теоретические и прикладные аспекты повышения резистентности осетровых рыб в аквакультуре. Автореф. дис. … док-ра биол. наук. Москва: ВНИРО, 2007. 46 с.
Германова М.А. Разнообразие индигенной микрофлоры рыб и её роль в развитии неспецифической резистентности / М.А. Германова, Н.А. Сидорова // Актуальные вопросы ветеринарной медицины и лабораторной диагностики: материалы международной научно-практической конференции, посвященной 100-летию со дня рождения профессора В.В. Рудакова. Санкт-Петербург: СПбГУВМ, 2023. С. 66-67.
Зайцева К.В. Сравнительный анализ микробиоценозов кишечника радужной форели (Oncorynchus mykiss) и водной среды в условиях садкового хозяйства / К.В. Зайцева, Д.А. Доколин, И.В. Злобин // Аграрный вестник Урала. 2022. № 12 (227). С. 42-53.
Ильмаст Н.В. Рыбное население пресноводных экосистем Карелии в условиях их хозяйственного освоения. Автореф. дис. … док-ра биол. наук. Москва: Институт проблем экологии и эволюции им. А.Н. Северцова РАН, 2012. 49 с.
Кузьмина В.В. Процессы пищеварения у рыб. Новые факты и гипотезы. Ярославль: Филигрань, 2018. 300 с.
Мирошникова Е.П. Аквакультура: практикум / Е.П. Мирошникова, С.В. Пономарёв. Оренбург: ОГУ, 2013. 184 с.
Сидорова Н.А. Санитарно-микробиологические исследования в рыбоводстве / Н.А. Сидорова, Л.П. Рыжков, Е.С. Обухова. Петрозаводск: Издательство ПетрГУ, 2013. 56 с.
Симонова Е.В. Роль нормальной микрофлоры в поддержании здоровья человека / Е.В. Симонова, О.А. Пономарева // Байкальский медицинский журнал. 2008. Т. 83, № 8. С. 20-26.
Spanggaard В. The microflora of rainbow trout intestine: a comparison of traditional and molecular identification / B. Spanggaard, I. Huber // Environmental Microbiology. 2000. Vol. 182. № 1-2. Р. 1-15.




