Введение
Несмотря на успех современных методов лечения, сердечно-сосудистые заболевания все еще являются самой частой причиной смертности и заболеваемости в Российской Федерации и в мире. В группу сердечно-сосудистых заболеваний входит ишемическая болезнь сердца (ИБС), цереброваскулярные болезни и заболевания периферических артерий. ИБС характеризуется формированием атеросклеротических бляшек в коронарных артериях и клинически проявляется стенокардией, а в худшем случае – острыми коронарными событиями, главным образом – острым инфарктом миокарда (ОИМ) [Silvis : 23].
Атеросклероз (АС) - прогрессирующее заболевание, характеризующееся аккумуляцией липидов, воспалительных клеток и фиброзных элементов в атеросклеротических бляшках. Эти нестабильные атеросклеротические бляшки - основная причина смертности от ИБС. Следовательно, вмешательства, которые проводятся с целью замедления прогрессирования атеросклероза и предотвращения осложнений атеросклероза, крайне важны. Более того, неотъемлемой частью лечения и профилактики АС является контроль факторов риска, которые способствуют прогрессированию АС (курение, малоподвижный образ жизни, неправильное питание, артериальная гипертензия, сахарный диабет), что приводит к уменьшению осложнений АС и смертности от ИБС. Но ключевым компонентом первичной и вторичной профилактики является контроль дислипидемии, в частности, снижение уровня липопротеинов низкой плотности (ЛПНП) на 1 ммоль/л уменьшает риск сердечных событий на 20 % [Silvis : 23].
Несмотря на изменение образа жизни и приверженности к терапии, направленной на контроль дислипидемии, у достаточно значимого количества пациентов все равно развиваются сердечно-сосудистые события. Эта проблема в современном лечении АС суммируется в концепции «остаточного риска», который может быть обусловлен воспалительным компонентом, в связи с чем предлагается терапия моноклональными антителами против провоспалительного интерлейкина 1-бета (ИЛ-1ß). Предполагается, что лечение иммунопрепаратами является эффективной альтернативой стандартной статиновой терапии АС, замедляет прогрессирование АС и уменьшает риск сердечно-сосудистых событий, однако остаются вопросы об оптимальных дозировках и побочных действиях [Ketelhuth : 1386, 1389].
Цель данной статьи заключается в проведении обзора основы концепции данного лечения и обзора существующих клинических исследований эффективности данного нового лечения АС путем анализа ключевых исследований.
Атеросклероз и воспаление
Воспаление является ключевым механизмом атерогенеза и рассматривается как процесс реакции на эндотелиальное повреждение. Вклад воспаления в развитие АС опосредован компонентами врожденной и адаптивной иммунной системы и включает в себя сложное взаимодействие циркулирующих и резидентных клеток, в частности нейтрофилов и макрофагов. Данное взаимодействие приводит к развитию и росту бляшки, ее дестабилизации и последующим сердечно-сосудистым событиям, к примеру, к тромбозу коронарных артерий и соответственно к ОИМ [Sylvis : 24].
Считается, что воспаление на ранней стадии атеросклероза является следствием повреждения эндотелия, вследствие чего запускается свёртывающая система крови, затем - вырабатываются молекулы адгезии, которые захватывают воспалительные клетки, мигрирующие в стенку артерии. Моноциты дифференцируются в макрофаги и фагоцитируют частицы ЛПНП, после чего образуются пенистые клетки. Пенистые клетки способствуют накоплению атеромы в бляшке и секретируют провоспалительные цитокины, такие как TNF-α и IL-1ß. Благодаря этим цитокинам усиливается развитие ранних морфологических элементов АС – жировых полосок. Более того, инфильтрация гладкомышечных клеток воспалительными клетками, привлеченных цитокинами, способствует развитию ранних атеросклеротических бляшек. Это приводит к более сложным поражениям эндотелия с фиброзной покрышкой. По мере роста бляшки в ней формируются новые сосуды. Данная неоваскуляризация может привести к кровоизлиянию в бляшку, усиливающему приток воспалительных клеток и липидов. Цитокины способствуют увеличению выработки и активации матриксных металлопротеаз, которые разрушают коллагеновые волокна в фиброзной покрышке. Разрыв фиброзной покрышки и последующий тромбоз может привести к окклюзии коронарной артерии и развитию серьезных сердечно-сосудистых осложнений, таких как ОИМ [Getz : 1–2]; [Hansson : 483].
Поскольку воспаление является ключевым процессом в возникновении и прогрессировании атеросклероза до образования нестабильных атеросклеротических бляшек, которые склоны к разрыву, воспалительные пути являются потенциальными мишенями в лечении атеросклероза в дополнение к липидснижающим препаратам [Silvis : 24-25].
Что такое инфламмасома?
Центром воспалительного процесса при атеросклерозе является комплекс инфламмасомы. Для начала необходимо обозначить, что из себя представляет это относительно новое понятие. Термин "инфламмасома" был впервые использован в 2002 году для обозначения мультибелкового комплекса, участвующего в активации каспазы-1, впоследствии приводящий к образованию ИЛ-1ß. ИЛ-1ß является хорошо изученным провоспалительным цитокином, играющим центральную роль во многих воспалительных заболеваниях. Инфламмасомы - это внутриклеточные белковые комплексы, которые объединяются после того, как рецепторы распознавания (PRR) связывают сигнальные молекулярные паттерны (DAMPs) или патоген-ассоциированные молекулярные паттерны (PAMP). DAMPs можно определить как эндогенные молекулы, высвобождающиеся после повреждения или стресса, такие как внеклеточный АТФ и холестерин (ХС). PAMP имеют экзогенное происхождение, например токсины, экспрессируемые бактериями и вирусами, которые выделяются при повреждении или стрессе. Идентифицировано несколько инфламмасом, а именно: the nucleotide-binding oligomerization domain (NOD); семейство leucine-rich repeat (LRR)-containing protein (NLR), NLRP1, NLRP3, NLRC4; proteins absent in melanoma 2 (AIM2) и pyrin инфламмасома. Каждая инфламмасома активируется различными стимулами и путями. Инфламмасома NLRP3 является наиболее изученной и охарактеризованной инфламмасомой [Broz : 410]. В целом, структура инфламмасомы NLRP3 представляет собой высокомолекулярный протеиновый комплекс, локализующийся в цитозоле и содержащий паттерн-распознающие рецепторы, сигнальные молекулы, ферменты (включая каспазы) и другие компоненты [Клинов].
Роль инфламмасомы в развитии атеросклеротического поражения
Считается, что возникновение АС является фактором, который активирует инфламмасому NLRP3, под действием которой образуются ХС и ЛПНП в тканях. Кроме того, в качестве факторов, активирующих NLRP3 инфламмасому, есть еще несколько активаторов, таких как мононатрий урат, внеклеточный АТФ, АФК. Zhang et al. сообщили, что ХС может нарушать функцию эндотелиальных клеток, способствуя их агрегации и затем активации NLRP3 инфламмасомы, что приводит к образованию атеросклеротических бляшек [Shao : 38]; [Zhang : 1084].
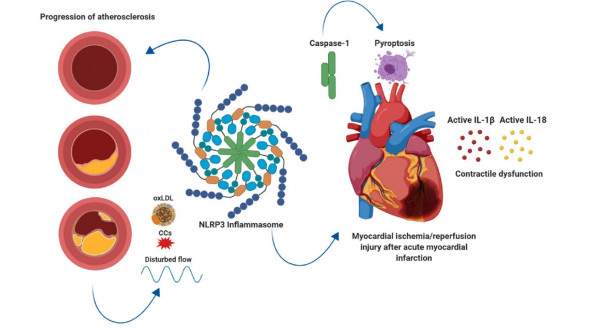
Рис. 1. Роль NLRP3 инфламмасомы в ИБС: прогрессирование АС и ишемия миокарда (реперфузионное повреждение) [Silvis : 30].
Ключевой момент пересечения АС и инфламммасом – это способность NLRP3 инфламмасомы активировать ИЛ1β [Karasawa : 446]. Роль ИЛ1β в развитии атеросклероза определяется многими механизмами, в частности, прокоагулянтная активность, усиление адгезии моноцитов и лейкоцитов к сосудистому эндотелию и роста сосудистых гладкомышечных клеток (см. рисунок 1). Было показано, что формирование атеросклеротических бляшек отсутствует при дефиците ИЛ1β у лабораторных животных. Более того, введение экзогенного ИЛ1, приводит к утолщению комплекса интима–медиа сосудистой стенки. В молекулярных механизмах развития атеросклероза, связанных с ИЛ1β, лабораторные исследования свидетельствуют о способности кристаллов ХС и других проатерогенных факторов индуцировать синтез ИЛ1β путем активации сборки NLRP3-инфламмасомы. Таким образом, NLRP3-инфламмасома и ИЛ1β – это потенциально эффективные мишени для новых препаратов, направленных на лечение АС [Насонов : 466].
Применение моноклональных антител в качестве лечение атеросклероза – опыт CANTOS
Подход к АС как к воспалительному заболеванию и, соответственно, применение этого тезиса в базовой терапии АС, привело к исследованию эффектов иммунотерапии на маркеры и прогрессирование АС. В 2017 году Ridker et al. опубликовали результаты применения моноклонального антитела канакинумаба для лечения АС пациентов с остаточным риском – CANTOS (Canakinumab Anti-inflammatory Thrombosis Outcome Study). Данное клиническое исследование является самым масштабным и ключевым в новой концепции АС, так как дало начальное развитие применения противовоспалительной терапии для лечения АС. Ridker et al. провели рандомизированное, двойное-слепое клиническое исследование эффективности канакинумаба [Ridker, 2017 : 1119].
Канакинумаб - это полностью человеческое моноклональное антитело, направленное против ИЛ-1β, обладающее противовоспалительным действием. Он одобрен для клинического применения при ревматологических заболеваниях. Раннее, в другом клиническом испытании канакинумаба, Ridker et al. провели исследование для пациентов с ревматологическими заболеваниями и с участием пациентов с диабетом, имеющих высокий сосудистый риск. Они обнаружили, что ингибирование ИЛ-1β с помощью канакинумаба заметно снизило плазменные уровни ИЛ-6 и высокочувствительного С-реактивного белка (СРБ) без снижения уровня ЛПНП [Ridker, 2012 : 2739–2740]. Таким образом, они предположили, что требуется проверка канакинумаба в воспалительной гипотезе атеротромбоза - то есть, насколько канакинумаб эффективен в лечении осложнений АС.
В исследовании CANTOS 10061 пациент был разделен на две группы: экспериментальная группа, получавшая канакинумаб, и контрольная группа, получавшая плацебо. Критерии включения: ОИМ в анамнезе и СРБ выше 2 мг/л. Экспериментальная группа была дальше разделена на три подгруппы. Одна подгруппа получала подкожно дозу 50 мг, вторая 150 мг, третья 300 мг, 1 раз в три месяца. Пациенты получали лечение до случившегося острого коронарного события. В промежуточном анализе через 48 месяцев после начала лечения в экспериментальной группе было выявлено значимое снижения уровня СРБ. Через 3,7 года после начала лечения количество острых коронарных событий было значительно меньше в экспериментальной группе, чем в контрольной группе. Доза 150 мг показала наилучшие результаты, так как в этой группе было самое выраженное снижение количества острых коронарных событий (по сравнению с плацебо-группой).
Следовательно, противовоспалительная терапия, направленная на путь врожденного иммунитета ИЛ-1β, с помощью препарата канакинумаб в дозе 150 мг раз в месяц привела к значительному снижению частоты повторных сердечно-сосудистых событий по сравнению с плацебо независимо от снижения уровня липидов. Таким образом, канакинумаб потенциально является эффективным альтернативным лечением АС у пациентов с остаточным риском [Ridker, 2017 : 1119-1120, 1129].
Оставшиеся вопросы
При проведении CANTOS также было выявлено, что в группе пациентов, получавших терапию канакинумабом, наблюдалась тромбоцитопения, но осложнений в виде кровотечений не было. Также, важно отметить, что в экспериментальной группе было большее количество инцидентов смерти от фатальных инфекций [Ridker, 2017 : 1129]. Таким образом, вопрос об опасных побочных действиях канакинумаба еще требует дополнительного исследования.
Заключение
Результаты исследования CANTOS имеют колоссальное значение для совершенствования вторичной профилактики и лечения атеросклероза и его осложнений. NLRP3 инфламмасома и ее соответствующие цитокины – значимые потенциальные мишени при лечении сердечно-сосудистых заболеваний. Стоит отметить, что в клинических испытаниях еще не исследовалось специфическое таргетирование внутриклеточных белков NLRP3 инфламмасомы. Экспансия подобных трансляционных исследований с использованием селективных ингибиторов компонентов NLRP3 необходима для полной оценки возможностей ингибирования NLRP3 инфламмасомы при лечении сердечно-сосудистых заболеваний. Также необходимы более детальные исследования канакинумаба на наличие опасных побочных эффектов.
Список литературы
Клинов В.В. Новые механизмы естественного иммунитета: инфламмасома NLRP3 // Кафедра иммунологии и аллергологии. Сибирский государственный медицинский университет [сайт]. URL: http://ssmu.immunology.sibhost.ru/IM/inflammasome_ru.html (дата обращения: 07 ноября 2023).
Насонов Е.Л. Противовоспалительная терапия атеросклероза - вклад и уроки ревматологии / Е.Л. Насонов, Т.В. Попкова // Научно-практическая ревматология. 2017. № 5. URL: https://cyberleninka.ru/article/n/protivovospalitelnaya-terapiya-ateroskleroza-vklad-i-uroki-revmatologii (дата обращения: 07.11.2023).
Broz P. Inflammasomes: mechanism of assembly, regulation and signalling / P. Broz, V.M. Dixit // Nature Reviews Immunology. 2016. № 16 (7). P. 407-420.
Getz G.S. Use of mouse models in atherosclerosis research / G.S. Getz, C.A. Reardon // Methods in Mouse Atherosclerosis. 2015. № 1339. P. 1-16.
Hansson G.K. Inflammation and plaque vulnerability / G.K. Hansson, P. Libby, I.I. Tabas // Journal of Internal Medicine. 2015. № 278 (5). P. 483-493.
Karasawa T. Role of NLRP3 inflammasomes in atherosclerosis / T. Karasawa, M. Takahashi // Journal of Atherosclerosis and Thrombosis. 2017. № 24 (5). P. 443-451.
Ketelhuth D.F. Immunometabolism and atherosclerosis: perspectives and clinical significance: a position paper from the Working Group on Atherosclerosis and Vascular Biology of the European Society of Cardiology / D.F. Ketelhuth, E. Lutgens, M. Bäck, C.J. Binder, J. Van den Bossche, C. Daniel, I.E. Dumitriu, I. Hoefer, P. Libby, L. O’Neill, C. Weber // Cardiovascular Research. 2019. № 115 (9). P. 1385-1392.
Ridker P.M. Effects of interleukin-1β inhibition with canakinumab on hemoglobin A1c, lipids, C-reactive protein, interleukin-6, and fibrinogen: a phase IIb randomized, placebo-controlled trial / P.M. Ridker, C.P. Howard, V. Walter, B. Everett, P. Libby, J. Hensen, T. Thuren // Circulation. 2012. № 126 (23). P. 2739-2748.
Ridker P.M. Antiinflammatory therapy with canakinumab for atherosclerotic disease / P.M. Ridker, B.M. Everett, T. Thuren, J.G. MacFadyen, W.H. Chang, C. Ballantyne, F. Fonseca, J. Nicolau, W. Koenig, S.D. Anker, J.J. Kastelein // New England Journal of Medicine. 2017. № 377 (12). P. 1119-1131.
Shao B.Z. NLRP3 inflammasome in atherosclerosis: putting out the fire of inflammation / B.Z. Shao, H.Y. Xu, Y.C. Zhao, X.R. Zheng, F. Wang, G.R. Zhao // Inflammation. 2023. № 46 (1). P. 35-46.
Silvis M.J. Immunomodulation of the NLRP3 inflammasome in atherosclerosis, coronary artery disease, and acute myocardial infarction / M.J. Silvis, E.J. Demkes, A.T. Fiolet, M. Dekker, L. Bosch, G.P. van Hout, L. Timmers, D.P. de Kleijn // Journal of Cardiovascular Translational Research. 2021. № 14. P. 23-34.
Zhang Y. Coronary endothelial dysfunction induced by nucleotide oligomerization domain-like receptor protein with pyrin domain containing 3 inflammasome activation during hypercholesterolemia: beyond inflammation / Y. Zhang, X. Li, A.L. Pitzer, Y. Chen, L. Wang, P.L. Li // Antioxidants & Redox Signaling. 2015. № 22 (13). P. 1084-1096.




